Nankai-Team hat den Wirkmechanismus des Tuberkulose-Medikaments Bedaquilin und seiner Derivate entschlüsselt. Die Ergebnisse wurden in nature veröffentlicht.

Vor einigen Tagen veröffentlichte die weltweit renommierte akademische Zeitschrift nature die neuesten Forschungsergebnisse von Prof. Gong Hongri, seines Kollegen Rao Zihe und der Mitarbeiter des College of Life Sciences der Nankai Universität online. Diese Studie deckt den molekularen Mechanismus von Bedaquilin (BDQ) und seines Derivates TBAJ-587 bei der Hemmung der ATP-Synthase von Mycobacterium tuberculosis und den Kreuzreaktivitätsmechanismus zwischen Bedaquilin (BDQ) und humaner ATP-Synthase auf, der für die Entwicklung einer neuen Generation hochselektiver Anti-Tuberkulose-Medikamente eine richtungsweisend ist.

Am 8. Juli fand die Ergebniskonferenz im Xingshen-Gebäude des Balitai-Campus der Nankai Universität statt. Yang Qingshan, Sekretär des Parteikomitees der Nankai Universität, und Rao Zihe, Mitglied der Chinesischen Akademie der Wissenschaften und ehemaliger Präsident der Nankai Universität, nahmen an der Pressekonferenz teil und hielten Reden. Zhong Nanshan, Mitglied der Chinesischen Akademie für Ingenieurwesen und Direktor des Guangzhou National Laboratory, hielt eine förmliche Rede. Shen Zhongyang, ehemaliger Präsident des Ersten Zentralkrankenhauses von Tianjin, Yao Zhi, ehemaliger Sekretär des Parteikomitees der Medizinischen Universität Tianjin, Li Liang, Vizepräsident des Thorax-Krankenhauses von Beijing und ehemaliger Vorsitzender der Tuberkulose-Abteilung der Chinesischen Ärztekammer, Guan Minxin, Direktor des Instituts für Genetik der Universität Zhejiang und ehemaliger Dekan der Fakultät für Biowissenschaften der Universität Zhejiang, Bi Lijun, Forscher des Nationalen Labors in Guangzhou, Vertreter der zentralen und lokalen Mainstream-Medien sowie Repräsentanten der Lehrer- und Studentenschaft der Nankai Universität, ungefähr 120 Menschen nahmen an den Feierlichkeiten teil, um diesen bahnbrechenden Fortschritt in der wissenschaftlichen Forschung mitzuerleben.
Zhong Nanshan, Mitglied der Chinesischen Akademie der Wissenschaften, erläuterte in seiner förmlichen Rede, dass der Durchbruch dieser wichtigen Errungenschaft, der von Prof. Gong Hongri, Akademiker Rao Zihe und seines Forschungsteams in der Forschungsrichtung für Tuberkulose-Medikamente erreicht wurde, nicht nur die Grundlagen der neuesten theoretischen Forschung auf dem Gebiet der Tuberkulose festigt, sondern auch mehr Möglichkeiten für die Entwicklung von Tuberkulose-Medikamenten mit höherer Selektivität bietet und auch einen praktischen Nutzen in ganz China haben wird. Das Nationallabor in Guangzhou wird dem Forschungsteam weiterhin dabei helfen, Tuberkulose-Medikamente mit guter klinischer Wirksamkeit, weniger Nebenwirkungen und mehr Sicherheit und Wirksamkeit auf der Grundlage dieser Errungenschaft zu finden, um das Hauptziel zu erreichen, der Gesundheit der Bevölkerung zu dienen.
Tuberkulose ist eine durch Mycobacterium tuberculosis verursachte Infektionskrankheit, die hauptsächlich in die Lunge eindringt und in schweren Fällen zum Tod führen kann, was weltweit eines der größten Probleme für die öffentlichen Gesundheit ist. Bedaquilin ist ein Inhibitor der ATP-Synthase, der auf Mycobacterium tuberculosis abzielt und das Wachstum von Mycobacterium tuberculosis wirksam hemmen kann. Es ist das erste Tuberkulose-Medikament, das im letzten halben Jahrhundert in der globalen Entwicklung von Tuberkulose-Medikamenten vermarktet wurde. Es wird von der Weltgesundheitsorganisation als bevorzugtes Medikament für die Langzeitbehandlung von Rifampicin-resistenter Tuberkulose und multiresistenter Tuberkulose aufgeführt.
Es wurde jedoch festgestellt, dass Bedaquilin aufgrund seiner Wechselwirkung mit dem Kaliumkanalprotein hERG ein erhöhtes Risiko für Herzrhythmusstörungen im Herzen des Patienten birgt und außerdem eine potenzielle Kreuzhemmung mit der menschlichen ATP-Synthase aufweist. Daher ist die Aufdeckung des Wirkmechanismus der ATP-Synthase von Mycobacterium tuberculosis sowie des Wirkmechanismus von Bedaquilin und seines molekularen Mechanismus zur Hemmung der Aktivität der menschlichen ATP-Synthase von großer Bedeutung für die Entwicklung neuartiger Mycobacterium-tuberculosis-ATP-Synthase-Inhibitoren.

Das Forschungsteam verwendete zunächst die „Knock-in-Knock-out-Overexpression“-Strategie in Kombination mit Affinitätschromatographie und Gelfiltrationschromatographie für die Proteinreinigung und erhielt schließlich eine homogene, stabile und aktive Probe des Mycobacterium tuberculosis ATP-Synthetase-Proteins mit Hilfe von Mycobacterium pubescens.
Anschließend untersuchte und optimierte das Forscherteam die Präparationsbedingungen für gefrorene Proben und löste erfolgreich die hochauflösende kryoelektronenmikroskopische Struktur der ATP-Synthase von Mycobacterium tuberculosis im an Bedaquilin gebundenen Zustand mittels Einzelpartikel-Kryoelektronenmikroskopie auf. (wie in Abbildung 1 gezeigt). Die Untersuchung hat gezeigt, dass Bedaquilin hauptsächlich durch die Chinolingruppe (Gruppe A) und die Dimethylaminogruppe (Gruppe D)stark mit der ATP-Synthase von Mycobacterium tuberculosis interagiert und an mehreren Stellen in der Transmembranregion angebunden war, was die Rotation des C-Rings bei der ATP-Synthase in der Transmembranregion verhinderte, wodurch der Protonentransport blockiert war und schließlich die Synthese von ATP verhindert wurde, um die erstrebte „Aushungerung“ von Mycobacterium tuberculosis zu erreichen.
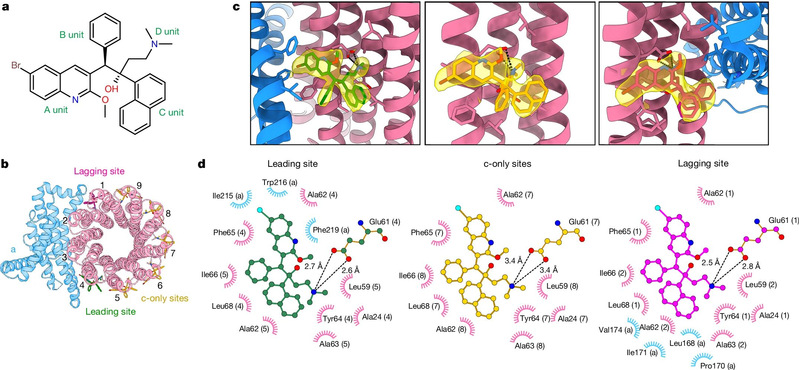
Abbildung 1: Kryo-EM-Struktur der ATP-Synthase von Mycobacterium tuberculosis in Kopplung mit Bedaquilin
Die typischsten Derivate von Bedaquilin sind TBAJ-587 und TBAJ-876, und die ausgesuchten Arzneimittel sind bereits Teil klinischer Studien. Das Forschungsteam deckte die hochaufgelöste Kryo-EM-Struktur der ATP-Synthase von Mycobacterium tuberculosis im Bindungszustand mit TBAJ-587 auf (Abbildung 2). Die Struktur zeigte, dass TBAJ-587 das gleiche Bindungsmuster wie Mycobacterium tuberculosis, ATP-Synthase und Bedaquilin aufwies. Darüber hinaus interagieren sowohl TBAJ-587 als auch Bedaquilin mit der ATP-Synthase von Mycobacterium tuberculosis, hauptsächlich über die Gruppen A und D.
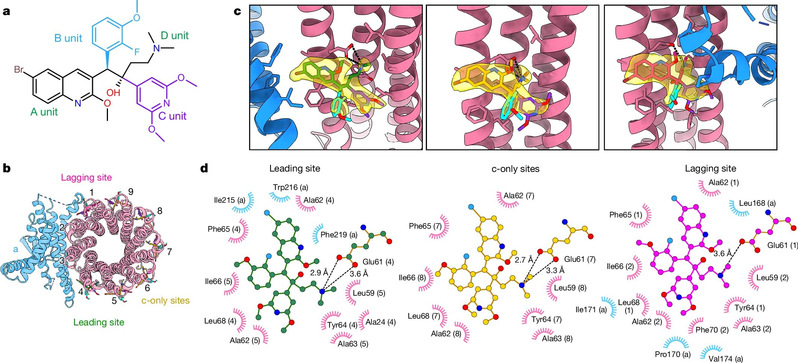
Abbildung 2: Die hochaufgelöste Kryo-EM-Struktur der ATP-Synthase von Mycobacterium tuberculosis im Bindungszustand mit TBAJ-587
Schließlich fanden die Forscher heraus, dass sowohl Bedaquilin als auch TBAJ-587 kreuzreaktiv auf die humane ATP-Synthase reagierten. Anschließend gelang es den Forschern, die Kryo-EM-Struktur des humanen ATP-Synthase-bindenden Bedaquilin aufzudecken (Abbildung 3). Die Analyse ergab, dass TBAJ-587 auf der Grundlage des Redesigns der B- und C-Gruppen in Bedaquilin das Risiko von Herzrhythmusstörungen reduzierte, die durch die Interaktion mit dem hERG-Protein verursacht wurden, und dass das Redesign und die Optimierung von Gruppe A die Interaktion mit der humanen ATP-Synthase verringern und dadurch die potenziellen Gesundheitsrisiken der klinischen Behandlung vermeiden könnten.
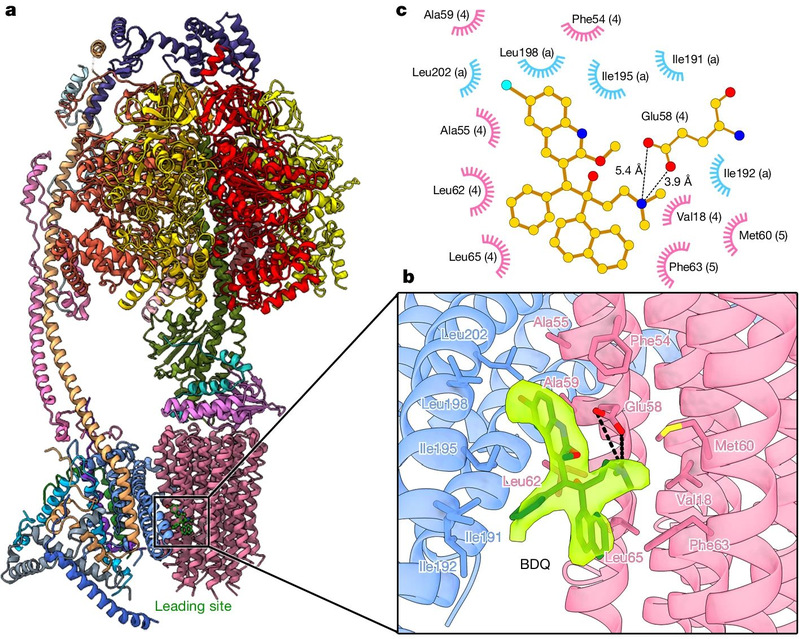
Abbildung 3: Die Kryo-EM-Struktur der humanen ATP-Synthase in Kopplung mit Bedaquilin
Erwähnenswert ist, dass die Fachzeitschrift nature auch Prof. Gregory Cook, den ehemaligen Vorsitzenden der international renommierten Gordon Conference on Bioenergetics, und seine Kollegen eingeladen hat, um ein Überblick in der Kolumne „News & Views“ über das Highlight der Untersuchung mit dem Titel „Muster für ATP-Synthase-Geräte werden das Design von Tuberkulose-Medikamenten unterstützen“ zu veröffentlichen.

Prof. Gong Hongri stellte vor, dass die Forschungsergebnisse von großer Bedeutung für die Grundlagenforschung und die klinische Transformation der Tuberkulose sind und eine Rolle bei der weiteren Optimierung von Bedaquilin und der Entwicklung ähnlicher oder sogar wirksamerer neuer Medikamente spielen werden.
Mitglieder der Chinesischen Akademie der Wissenschaften Rao Zihe erklärte: „Unser Team engagiert sich seit langem für die Erforschung der Struktur und Funktion von pathogenen Proteinen, die mit neu auftretenden und wieder auftretenden Infektionskrankheiten im Zusammenhang stehen, sowie für die Erforschung und Entwicklung innovativer Medikamente. Derzeit haben wir mit der Forschung zur Entwicklung neuer ATP-Synthase-Hemmer gegen Mycobacterium tuberculosis begonnen und bemühen uns, so schnell wie möglich neue Medikamente gegen Tuberkulose zu entwickeln, die mit unabhängigen geistigen Eigentumsrechten verbunden sind.“

Zhang Yuying and Lai Yuezheng, Bachelor-Master-Doktorand-Studierende der Nankai, sind Co-Erstautoren dieser Arbeit. Prof. Gong Hongri vom College of Life Sciences der Nankai Universität und Akademiemitglied Rao Zihe, der assoziierte Forscher Liu Fengjiang vom Guangzhou Laboratory und der assoziierte Forscher Gao Yan vom Shanghai Institute for Advanced Immunochemical Studies (SIAIS) der ShanghaiTech University sind korrespondierende Autoren. Die Nankai Universität ist die erste Abschlusseinheit.
Die oben genannte Arbeit wurde unter anderem vom Chinesischen Forschungs- und Entwicklungsprogamm für Nachwuchswissenschaftler und der Chinesischen Naturwissenschaftlichen Stiftung für Hervorragende Nachwuchswissenschaftler unterstützt.

Link zur Studie:
https://www.nature.com/articles/s41586-024-07605-8